- L'organe
- Justification du traitement
- L'imagerie
- Description du geste
- Suite habituelles
- risques et complications
- Avantages du traitement
- Pour conclure
-
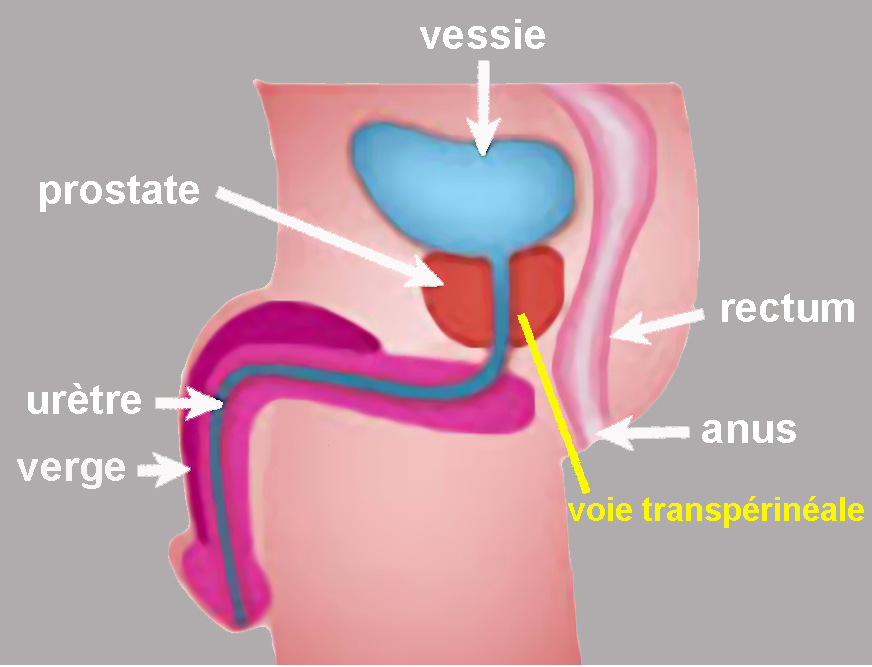
L'organe
La prostate est une glande située sous la vessie et derrière le pubis. Pour vider la vessie, l'urine doit s’écouler par l’urètre qui traverse la prostate. Le périnée, entre la racine de la verge et l’orifice anal, est l’abord choisi pour l’ablation laser du cancer. On évite ainsi la voie transrectale, source d’infections prostatiques par contamination à partir de bactéries intestinales.
Figure 1. Anatomie de la prostate. La prostate est située sous la vessie, en avant du rectum et au-dessus du périnée. L’abord transpérinéal (trait jaune) passe entre l’orifice anal et la racine de la verge. -
Justification du traitement
Le traitement focal est justifié par la détection de plus en plus fréquente de cancers de prostate à faible risque de progression, dont le traitement dit radical par ablation chirurgicale ou radiothérapie visant toute la glande n’est pas indiqué dans l’immédiat. Ces traitements peuvent avoir des effets indésirables (incontinence urinaire, impuissance sexuelle, toxicité rectale et/ou vésicale, urétrite radique) avec un retentissement parfois important sur la qualité de vie.
Pour éviter ces effets indésirables, une des solutions est de proposer une surveillance dite active de la tumeur par un dosage de PSA, une IRM de la prostate suivie de biopsies dirigées dans la tumeur tous les ans. Le traitement radical n’est proposé que si des signes de progression apparaissent. Cette prise en charge peut être une source d’angoisse, car le risque de progression n’est pas supprimé. Elle expose également au risque infectieux des biopsies transrectales répétées. Ainsi, plus d’un tiers des patients inclus dans les protocoles de surveillance active demandent-ils à en sortir à moyen terme pour réclamer un traitement radical.
Entre ces deux prises en charges extrêmes (surveillance et traitement radical), une solution intermédiaire consiste à proposer une ablation focale par énergie laser du foyer tumoral le plus agressif, en épargnant le reste du tissu prostatique. On supprime le risque de progression tout en évitant les effets secondaires potentiellement importants des traitements radicaux. -
L'imagerie
l’ imagerie au centre de la précision diagnostique et therapeutiqueC’est la fiabilité de l’IRM et de la micro-échographie pour localiser les foyers tumoraux du cancer (figure 2) qui ont permis de développer le traitement focal. La microéchographie. utilise une sonde de très haute fréquence, fonctionnant à 29 MhZ (ExactVu, Exact Imaging, Canada) (3) qui procure une résolution spatiale de 70 microns, soit trois fois supérieure à celle de l’échographie conventionnelle (3). Les contours de la lésion sont bien délimités, comme à l’IRM (figure 2), ce qui rend précis le guidage de la biopsie et du traitement laser.
Figure 2 : Localisation de la lésion par IRM et micro-échographie (microUS). Patient de 64 ans. Taux de PSA : 7,4 ng/mL.

A (IRM, coupe sagittale) : La tumeur (flèche) est située dans la partie antérieure de la prostate, à peu près à mi-hauteur entre l’apex et la base.
B IRM, (coupe sagittale) : superposition des images morphologiques pondérées en T2 avec la séquence de diffusion (T2W+DWI), qui augmente de façon spectaculaire la visibilité de la lésion (flèche blanche).
C (microUS, coupe sagittale) : La tumeur est hypoéchogène (tonalité gris foncé, flèches blanches). Sur les biopsies ciblées, cancer de prostate, score de Gleason 3+4 avec faible contingent de grade 4 (20%) -
Description du geste
Le patient est installé en position gynécologique. Après désinfection locale du périnée, anesthésie locale du périnée et injection intraveineuse d’un produit sédatif, la sonde de microéchographie est insérée par voie rectale. Une aiguille est introduite dans le guide à ponction de la sonde et placée, par voie percutanée transpérinéale (figure 1), au centre de la tumeur (figure 3A). Une fibre laser, introduite dans l’aiguille qui a servi à la ponction, est utilisée pour délivrer l'énergie laser interstitielle (figure 3A). Le traitement ne dure que quelques minutes. L’IRM après traitement confirme l’étendue de la zone traitée.
Figure 3 : Placement de la fibre laser au centre de la tumeur, application de l’énergie laser et contrôle par IRM de la zone traitée.
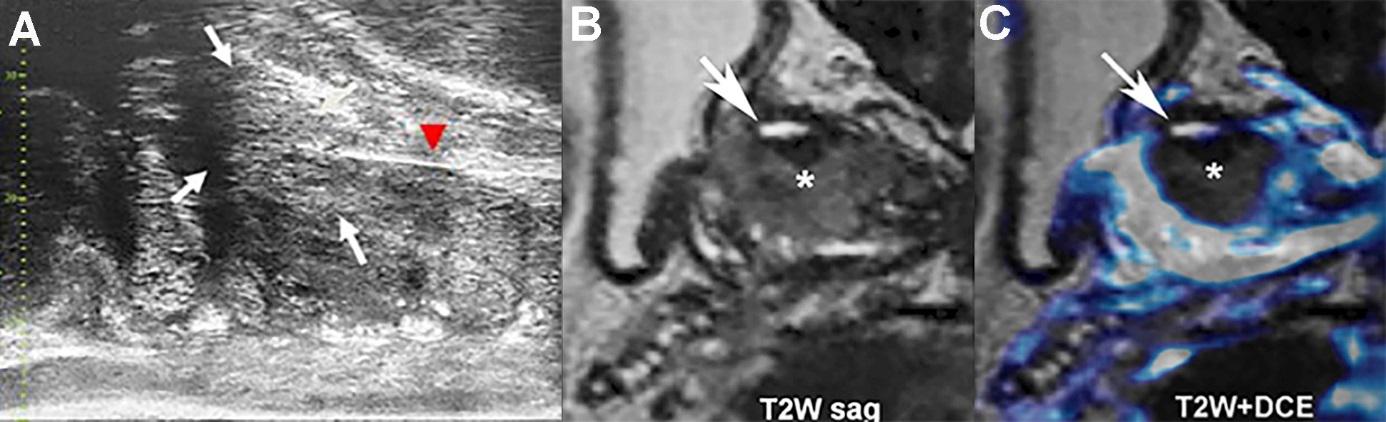
A : L’écho linéaire (trait blanc, têtes de flèche rouge) correspond à la fibre laser placée au centre de la lésion. Après application de l’énergie laser, la lésion est devenue hyperéchogène (tonalité gris clair, flèches blanches), délimitant la zone traitée.
B et C : IRM juste après traitement.
B Avant injection de produit de contraste. L’hypersignal (flèche) correspond à une cavitation minime de la zone détruite.
C: Après injection (couleur bleue). Image superposée à l’image avant injection. La zone entièrement dévascularisée (*) correspond à la tumeur nécrosée entourée d’une marge de sécurité carcinologique, qui dépasse les limites de la tumeur et garantit une ablation complète. -
Suite habituelles
La sortie de l’établissement a lieu quelques heures après le traitement. La sonde vésicale est enlevée une heure avant la sortie et le patient est autorisé à quitter l’établissement après avoir uriné. Les visites de suivi (1, 6, 12 et 24 mois) sont celles recommandées dans les soins courants après traitement d’un cancer de prostate, pour vérifier l’état mictionnel, le taux du PSA et l’état fonctionnel (continence urinaire et qualité de l’érection). A la visite du 12ème mois, on rajoute les examens recommandés lors d’une surveillance active : IRM et biopsies ciblées de la zone traitée. -
risques et complications
Les risques sont liés à la proximité des structures adjacentes qui ne doivent pas être lésées pendant le traitement.
La paroi rectale : le risque est une fistule urétro-rectale, c’est-à-dire une communication entre l’urètre et le rectum. Il s’agit d’une complication exceptionnelle, théoriquement possible en cas de tumeur postérieure proche du rectum. Elle est prévenue par une hydrodissection qui écarte la paroi rectale de la prostate et par le contrôle de la température par une sonde placée entre la paroi rectale et la prostate. La fistule urétro-rectale nécessite une intervention chirurgicale pour la réparer.
Le sphincter distal : une lésion de l’extrême apex peut faire récuser le traitement focal si existe un risque d’endommager le sphincter, et donc de créer une incontinence urinaire.
L’urètre : en cas de tumeur proche de l’urètre, on met en place une sonde vésicale avant le traitement pour irrigue la vessie et l’urètre par perfusion de sérum physiologique refroidi, ce qui protège l’urètre d’une élévation excessive de la température.
-
Avantages du traitement
avantages du traitement focal laser du cancer de la prostateLe bénéfice pour le patient et la santé publique repose sur la légitimité de la thérapie focale pour les tumeurs à risque de progression faible ou intermédiaire (1). Il trouve sa place entre les deux extrêmes représentés par la surveillance active d’un côté et le traitement radical par chirurgie ou irradiation de l’autre.
Si la référence est la prise en charge la moins agressive du cancer (surveillance active), l’avantage attendu de l'ablation focale au laser est carcinologique. En effet, les patients éligibles pour une surveillance active et porteurs d’une tumeur visible à l'IRM ont un risque accru de progression (5). On attend du traitement focal qu’il supprime ou réduise le risque de progression tumorale, en évitant un traitement radical immédiat et sa morbidité potentiellement importante.
Si la référence est la prise en charge la plus agressive du cancer (prostatectomie radicale), l'avantage prévisible est une diminution très importante de la morbidité. En effet, la prostatectomie totale en est la cause d'incontinence urinaire dans environ un tiers des cas et d'un dysfonctionnement érectile chez plus de la moitié des patients.
-
Pour conclure
La microéchographie est le moyen de guidage le plus simple pour obtenir les bons résultats carcinologiques et fonctionnels d’un traitement focal guidé par imagerie, car elle permet de suivre la progression la zone de nécrose tumorale en temps réel, comme le guidage IRM direct. Le respect de l’urètre, l’utilisation d’une aiguille de fin calibre et l’absence de complications ou d’effets secondaires illustrent le caractère très mini-invasif d’un tel traitement, réalisable à la clinique de l’Alma grâce à une collaboration très étroite entre urologues et radiologues interventionnels.
Références
1. van Luijtelaar A, Greenwood BM, Ahmed HU, Barqawi AB, Barret E, Bomers JGR, et al. Focal laser ablation as clinical treatment of prostate cancer: report from a Delphi consensus project. World J Urol. 2019;37(10):2147-53.
2. Garcia-Barreras S, Sanchez-Salas R, Sivaraman A, Barret E, Secin F, Nunes-Silva I, et al. Comparative Analysis of Partial Gland Ablation and Radical Prostatectomy to Treat Low and Intermediate Risk Prostate Cancer: Oncologic and Functional Outcomes. J Urol. 2018;199(1):140-6.
3. Ghai S, Eure G, Fradet V, Hyndman ME, McGrath T, Wodlinger B, et al. Assessing Cancer Risk on Novel 29 MHz Micro-Ultrasound Images of the Prostate: Creation of the Micro-Ultrasound Protocol for Prostate Risk Identification. J Urol. 2016;196(2):562-9.
4. Cornud F, Lefevre A, Flam T, Dumonceau O, Galiano M, Soyer P, et al. MRI-directed high-frequency (29MhZ) TRUS-guided biopsies: initial results of a single-center study. Eur Radiol. 2020.
5. Park BH, Jeon HG, Choo SH, Jeong BC, Seo SI, Jeon SS, et al. Role of multiparametric 3.0 tesla magnetic resonance imaging in prostate cancer patients eligible for active surveillance. BJU Int. 2013.